Kanda et al., JGV 2022
Establishment of a reverse genetics system for avian rotavirus A strain PO-13
(鳥類ロタウイルスA PO-13株の遺伝子操作系の確立)
Kanda et al., J Gen Virol., 2022
ロタウイルスは、主に乳幼児や若齢動物に感染し、重篤な下痢を伴う腸炎を引き起こします。特に、鳥類に感染する鳥ロタウイルスは、家禽産業に深刻な被害をもたらす可能性がある病原体として注目されています。最近では、世界各国のレース鳩において流行し、大きな被害をもたらしました。また、一部の鳥ロタウイルスは、まれに哺乳動物にも感染し、下痢や脳炎を発症させます。このことは一部の鳥ロタウイルスが動物や人の健康に対してリスクを有することを示しています。一方で、大部分の鳥ロタウイルスは哺乳動物に病原性を示さないと考えられています。このような病原性の差が生まれるメカニズムは不明ですが、これが解明されれば、各々の鳥ロタウイルス株の塩基配列に基づき、哺乳動物に感染するリスクの評価が可能になると期待できます。このような病原性メカニズムを分子レベルで明らかにするためには、ウイルスの遺伝子操作系が極めて有用です。しかし、ロタウイルスの遺伝子操作系は、人を含む哺乳動物由来のウイルス計5株で確立されているのみで、鳥ロタウイルス株の本系はこれまで存在していませんでした。
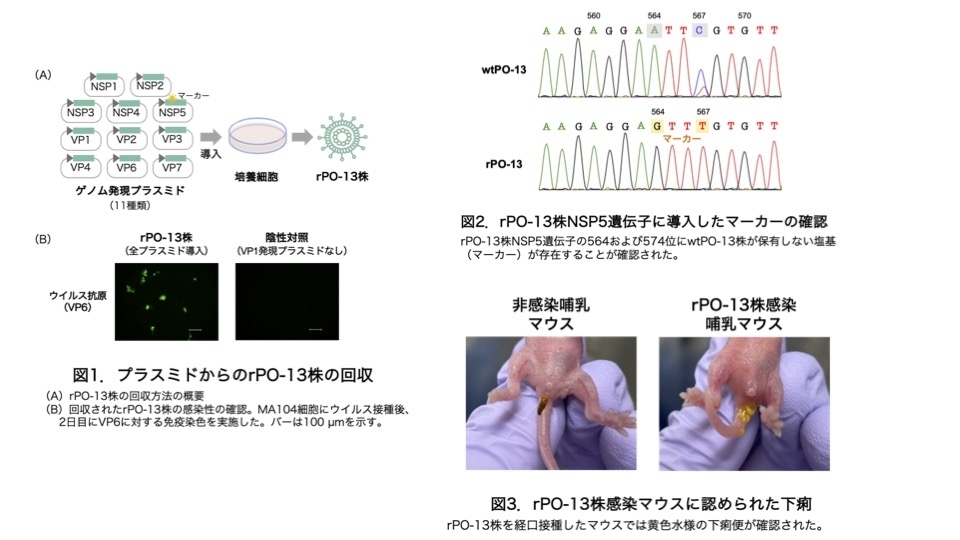
今回我々は、鳥ロタウイルスの遺伝子操作系を世界で初めて確立しました。具体的には、哺乳マウスに病原性を有することが確認されているドバト由来PO-13株の遺伝子操作が可能となりました。最初に、PO-13株のゲノムRNA分節(計11本)を発現する11種類のプラスミドを構築しました。なお、プラスミド上のあるウイルス遺伝子に、本来のPO-13株(wtPO-13株)が保有しない塩基配列を「目印(マーカー)」として導入しました。このマーカーは、アミノ酸置換を伴わない塩基置換の導入によって構築されたため、当該ウイルス蛋白質のアミノ酸配列には影響を及ぼしません。上記11種類のゲノム発現プラスミドを培養細胞に導入した結果、感染性を有する人工ウイルス(rPO-13株)の回収に成功しました(図1)。さらに、rPO-13株が当該ウイルス遺伝子上に導入したマーカーを保有することを確認しました(図2)。すなわち、ゲノム発現プラスミドの遺伝子操作により、PO-13株の遺伝子改変が可能であることが証明されました。培養細胞におけるrPO-13株の増殖性は、wtPO-13株と同等であることが判明しました。rPO-13株を経口接種することで、哺乳マウスが下痢を発症することを確認しました(図3)。さらなる検証により、哺乳マウスに対するrPO-13株の病原性は、wtPO-13株と同等であることが確認されました。
本研究において確立されたPO-13株の遺伝子操作系は、鳥類だけでなく哺乳動物における鳥ロタウイルスの病原性メカニズムの解明に極めて有用です。例えば、本系の活用により、哺乳動物に対する病原性を決定するウイルス遺伝子配列が特定できれば、自然界に存在する様々な鳥ロタウイルス株の感染リスクをこれらの塩基配列から推定することが可能になります。
本研究は、藤田医科大・河本聡志准教授らのグループとの共同研究として実施されました。当研究室では、2名の学生さん(R1年度卒 濱田七々実さん、R3年度卒 神田茉莉花さん)を中心に
卒業研究の一環として実施されました。