Kojima et al. J. Virol. 2022
The amino acid at position 95 in the matrix protein of rabies virus is involved in antiviral stress granule formation in infected cells.
(狂犬病ウイルスM蛋白質95位のアミノ酸は感染細胞における抗ウイルスストレス顆粒形成に関与する)
Kojima et al., J. Virol., 2022
細胞は、外部からの刺激(化学物質、温度、pH変化など)を受けると、細胞質内に「ストレス顆粒(Stress granules: SG)」と呼ばれる顆粒状の構造を一時的に形成します。これまで、SGの機能としては、翻訳前のmRNAを一時的に貯蔵することで異常蛋白質の蓄積を防いだり、シグナル伝達経路を調節したりすることが知られていました。
最近になり、SGの機能として、抗ウイルス自然免疫における重要な役割が明らかとなりました。具体的には、ウイルス感染を認識し自然免疫応答を活性化するのに重要な「センサー蛋白質」であるRIG-Iは、SGに集積し、そこでウイルスRNAを感知することが示されました。つまりSGは、ウイルス感染認識と自然免疫発動開始の「場」であることが分かっています。
狂犬病ウイルスが感染するとSGが形成されることはすでに知られていましたが(Nikolic et al., PloS Pathog. 2016)、病原性の異なる株間での比較は行われていませんでした。そこで我々は、マウスに対して高い致死性を示す西ヶ原株と、その鶏胚細胞継代株であり致死性が欠失したNi-CE株のSG形成能を比較したところ、Ni-CE株感染細胞では強いSG形成が認められたのに対し、西ヶ原株感染ではほぼ認められませんでした(図1)。さらに3種類の野外流行株でも実験した結果、これらの感染細胞でもSG形成はみられませんでした。

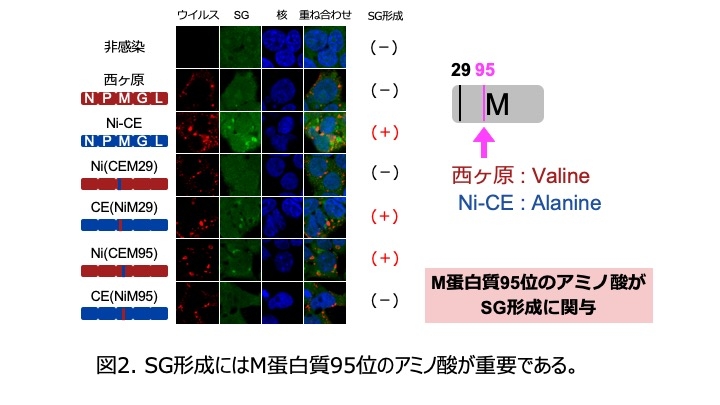
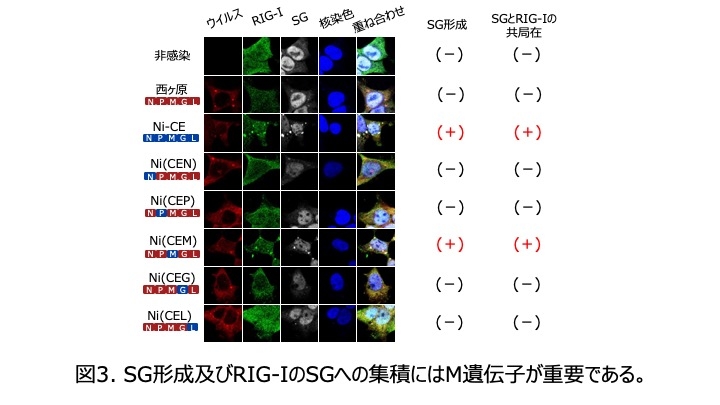
狂犬病ウイルスの5つの遺伝子のうちどの遺伝子がSG形成誘導に重要か調べる目的で、西ヶ原株のゲノムをもとに、一つずつNi-CE株の遺伝子と置換した5種類のキメラウイルスを作出し、SG形成能を比較した結果、M遺伝子のみNi-CE株型のキメラウイルスNi(CEM)株のみがSG形成を強力に誘導しました。さらなる解析の結果、SG形成誘導能はM蛋白質95位のアミノ酸のちがいによって支配されることが示されました(図2)。
各ウイルス株感染細胞におけるRIG-Iの局在を解析した結果、Ni-CE株、Ni(CEM)株および西ヶ原株のM蛋白質95位のアミノ酸のみNi-CE株型に変えた点変異株ではRIG-IがSGに集積している像が観察されました(図2)。一方、西ヶ原やその他のキメラウイルスではそのような像はみられませんでした。
さらなる実験により、抗ウイルス自然免疫に重要であり、RIG-I活性化によって産生されるインターフェロンβの発現量を解析した結果、M蛋白質95位のアミノ酸が西ヶ原型であれば発現量が低く、Ni-CE型であれば高くなることがわかりました。
以上より、狂犬病ウイルスの病原性決定メカニズムの一つとして、SGの形成回避による自然免疫系抑制が考えられること、その重要な決定基としてM蛋白質95位のアミノ酸を同定することができました。狂犬病ウイルスに限らず他のウイルスも含め、病原性とSG形成の関連を明らかにし、その決定アミノ酸を明らかにした研究は初めてとなります。
本研究は、RIG-Iの発見者である京都大学医生物学研究所 藤田尚志博士及び千葉大学真菌医学研究センター 米山光俊博士、尾野本浩司博士らとの共同研究として正谷が大学院生の時からスタートした研究を、ようやくまとめたものです(長くかかりすぎました・・・)。鹿児島大学共同獣医学研究科 児島一州さんの学位の基礎となる学術論文として発表することができました。

